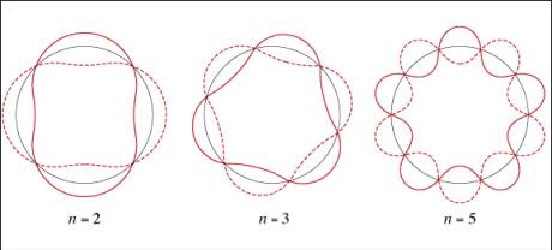
In der Abbildung sind die Bahnen aus grafischen Gründen alle gleich groß gezeichnet, wodurch die Wellenlängen mit wachsendem n kürzer werden. Es müßten umgekehrt die Bahnen immer größer gezeichnet werden und die Wellenlänge konstant bleiben. Elektronenbahnen mit hoher Quantenzahl sind nur unter extrem kalten Bedingungen stabil. Solche Riesenatome, genannt Rydberg-Atome, können heute erzeugt werden. Ein Wasserstoffatom mit der Quantenzahl n=600 ist bereits 20 Mikrometer gross. Diese Exoten sind u.a. interessant, weil sie den Grenzbereich zwischen klassischer und Quantenmechanik der direkten Beobachtung zugänglich machen.
Leider funktioniert das plausible, wenn auch physikalisch nicht ganz schlüssige Bohrsche Atommodell nicht für Atome mit mehr als einem Elektron. Während sich das Strahlungsspektrum von Wasserstoff damit gut begründen läßt, gilt dies schon nicht mehr für Helium (zwei Elektronen).
 Szene
Szene


 1. Slide
1. Slide
 Branching Point
Branching Point
 Module: Mikrowelt: Bose-Einstein-Kondensat/Photonenstatistik
Module: Mikrowelt: Bose-Einstein-Kondensat/Photonenstatistik Sequence: lev0_start
Sequence: lev0_start Branching Point: Teilchen und Licht unter Kontrolle
Branching Point: Teilchen und Licht unter Kontrolle Slide: Funktionsprinzip der Paul-Falle
Slide: Funktionsprinzip der Paul-Falle Zurück
Zurück

